Алканы нормального строения. Международная номенклатура алканов
Алканы (предельные углеводороды, парафины) – насыщенные углеводороды, в молекулах которых атомы углерода и водорода связаны только -связями.
Общая формула алканов – С n H 2 n +2 .
В молекулах алканов атомы углерода находятся в sp 3 -гибридном состоянии и каждый из них образует 4 -связи с атомами углерода и (или) водорода. Состояние sp 3 -гибридизации характеризуется тетраэдрической конфигурацией атома углерода.
Природные источники
Природными источниками алканов являются нефть, попутные нефтяные газы и природный газ.
Наибольшее значение имеет нефть. Нефть представляет собой сложную смесь органических соединений, в основном углеводородов. В ней также содержатся в небольшом количестве кислород-, азот- и серосодержащие соединения. В зависимости от месторождения нефти углеводородный состав может быть представлен как алканами, так и другими группами углеводородов. Нефть используется как топливо и ценное сырье для химической промышленности.
В настоящее время существует несколько способов промышленной переработки нефти.
Перегонка. Это физический способ переработки нефти. Углеводороды нефти различаются по молекулярным массам, а следовательно, и температурам кипения. Поэтому простой перегонкой нефть можно разделить на ряд фракций, различающихся по температурам кипения. Таким способом получают петролейный эфир (до 60°С; C 5 –С 6); авиационный бензин (60–180°С; С 6 –С 10); бензин (до 200°С; С 11 –C 12); керосин и реактивное топливо (175–280°С; С 7 –С 14); дизельное топливо (200–350°С; С 13 –C 18). Фракция, имеющая температуру кипения выше 360°С, называется мазутом (С 18 –С 25). Фракция, содержащая углеводороды С 25 и более высокомолекулярные углеводороды, не перегоняется; из нее получаются тяжелые масла, вазелин, парафин.
Каталитический крекинг. В отличие от перегонки, крекинг (от англ. cracking – расщепление) представляет собой процесс химической переработки нефти, заключающийся в расщеплении высших углеводородов и получении более ценных низших алканов, составляющих, например, фракцию бензина и т.д. При нагревании нефти до температуры 500°С в присутствии алюмосиликатных катализаторов (оксид алюминия Аl 2 O 3 на силикагеле SiO 2) происходит разрыв связей между атомами углерода в цепи и образуются алканы с меньшим числом атомов углерода (C 5 –C 10) и разветвленной цепью.
Природный газ состоит в основном из метана (до 95%) с небольшой примесью этана и пропана. Попутный нефтяной газ, кроме метана, содержит значительное количество этана, пропана, бутана. Природный и нефтяной газы используются как высококалорийное топливо, а также как сырье для ряда крупных химических производств. Метан составляет сырьевую основу важнейших химических процессов получения углерода и водорода, ацетилена, кислородсодержащих органических соединений – спиртов, альдегидов, кислот.
Получаемый при термическом разложении (пиролизе) метана (1) мелкодисперсный углерод (сажа) используется как наполнитель при производстве резины, типографских красок. Водород используется в различных синтезах, в том числе в синтезе аммиака. При высокотемпературном крекинге метана (2) получается ацетилен. Необходимая высокая температура (1400–1600°С) создается электрической дугой. При мягком окислении метана кислородом воздуха в присутствии катализаторов (3) получаются ценные для органического синтеза и производства пластмасс вещества: метиловый спирт, формальдегид, муравьиная кислота.
СН 4 С + 2Н 2 (1)
2СН 4
 НССН
+ 3Н 2 (2)
НССН
+ 3Н 2 (2)

Способы получения
Важнейшие синтетические методы получения:
1. Гидрирование непредельных углеводородов .
СН 3 –СН=СН–СН 3
+ Н 2
 СН 3 –СН 2 –СН 2 –СН 3
СН 3 –СН 2 –СН 2 –СН 3
бутен-2 бутан
(катализатор – никель, платина или палладий).
2. Получение из галогенопроизводных (реакция Ш.А. Вюрца, 1854 г.).
2СН 3 I + 2Na CH 3 –CH 3 + 2NaI.
иодметан этан
3. Получение из солей карбоновых кислот (лабораторный способ).
СН 3 СООNa (тв.)
+ NaOH (тв.).
 CH 4
+ Na 2 CO 3 .
CH 4
+ Na 2 CO 3 .
ацетат натрия метан
В этих реакциях, как правило, берется не чистый гидроксид натрия, а его смесь с гидроксидом кальция, называемая натронной известью . Исходные вещества предварительно прокаливают.
4. Прямой синтез из углерода и водорода .
В электрической дуге, горящей в атмосфере водорода, образуется значительное количество метана:
С + 2Н 2 СН 4 .
Такая же реакция идет при температуре 400–500С, давлении порядка 30 МПа и в присутствии катализатора – железа или марганца. Эта реакция имеет большое практическое значение для получения смеси углеводородов – синтетического бензина.
5. Получение из синтез-газа .
nСО
+ (2n+1)H 2
 C n H 2n+2
+ nH 2 O.
C n H 2n+2
+ nH 2 O.
синтез-газ
Физические свойства
В обычных условиях (при 25°С и атмосферном давлении) первые четыре члена гомологического ряда алканов (C 1 – С 4) – газы. Нормальные алканы от пентана до гептадекана (С 5 – C 17) – жидкости, начиная с С 18 и выше – твердые вещества. По мере увеличения числа атомов углерода в цепи, т.е. с ростом относительной молекулярной массы, возрастают температуры кипения и плавления алканов. При одинаковом числе атомов углерода в молекуле алканы с разветвленным строением имеют более низкие температуры кипения, чем нормальные алканы.
Алканы практически не растворимы в воде, так как их молекулы малополярны и не взаимодействуют с молекулами воды. Жидкие алканы легко смешиваются друг с другом. Они хорошо растворяются в неполярных органических растворителях, таких как бензол, тетрахлорметан (четыреххлористый углерод), диэтиловый эфир и др.
Химические свойства
В химическом отношении алканы малоактивны, за что и были названы парафинами (от лат. parum affinis – лишенные сродства). Это объясняется прочностью -связей, устойчивость которых обусловлена малым размером атома С и его тетраэдрической конфигурацией, что способствует максимальной концентрации электронной плотности между ядрами атомов. -Связь С–Н мало поляризована вследствие близости электроотрицательностей атомов С и Н. В силу этого алканы – малополярные вещества и труднополяризуемые, на них не действуют кислоты, щелочи, обычные окислители (например, КМnО 4), металлы.
Для алканов возможен гомолитический (радикальный) разрыв связей, при этом происходят реакции замещения атомов Н, расщепления углеродного скелета (крекинг), окисления (частичного или полного).
1. Реакции замещения .
– Хлорирование.
В качестве примера реакций замещения рассмотрим реакцию хлорирования метана, которая относится к цепным радикальным реакциям. Процесс протекает энергично на свету или при нагревании (до 250–400 о С). Первая стадия называется зарождением , или инициированием , цепи:
(под действием энергии квантов света или высокой температуры некоторые молекулы хлора гомолитически расщепляются на 2 атома, имеющих неспаренные электроны, – свободные радикалы).
Сl + CН 4 НСl + СН 3 (метил); СН 3 + Сl 2 СН 3 Сl + Сl и т.д.
Обрыв цепи происходит, если сталкиваются два свободных радикала; при этом могут образоваться молекулы С 2 Н 6 , СН 3 Сl, Сl 2 .
При хлорировании других алканов легче всего замещение идет у третичного атома углерода (атома, который затрачивает на С–С-связь 3 валентности), затем у вторичного и в последнюю очередь – у первичного. При образовании полигалогензамещенных соединений атомы хлора преимущественно замещают атомы водорода у одного и того же или у соседних атомов углерода. – Закономерности В.В. Марковникова.
– Нитрование (реакция М.И. Коновалова, 1888 г.).
Реакцию проводят 10%-ной азотной кислотой при температуре около 140С и небольшом давлении.
2. Окисление .
В промышленности алканы окисляют кислородом воздуха на марганцевых катализаторах при температуре около 200С. При этом расщепляются С–С-связи и получаются низкомолекулярные кислородсодержащие соединения – спирты, альдегиды, кетоны, карбоновые кислоты (см. Природные источники ). Алканы горят на воздухе с выделением большого количества теплоты. Поэтому они широко используются в быту и технике в качестве высококалорийного топлива.
СН 4 + 2О 2 СО 2 + 2Н 2 О + 890 кДж.
Алкены
Алкены (этиленовые углеводороды) – ненасыщенные углеводороды, молекулы которых содержат одну двойную связь С=С.
Общая формула алкенов – С n H 2 n .
Двойная связь образуется при помощи двух пар обобщенных электронов. Атомы углерода, связанные двойной связью, находятся в состоянии sp 2 -гибридизации, каждый из них образует 3 -связи, лежащие в одной плоскости под углом 120. Негибридные р-орбитали атомов углерода расположены перпендикулярно плоскости -связей и параллельны друг другу и вследствие «бокового» перекрывания образуют -связь, электронное облако которой расположено частично над, а частично под плоскостью молекулы.
Способы получения
1. Пиролиз алканов .
Пиролиз – процессы химических превращений органических соединений, происходящие при высокой температуре.
Пиролиз алканов является важнейшим промышленным способом получения алкенов из высококипящих фракций нефти. Под действием сильного нагревания (до 700 о С) в молекулах алканов гомолитически расщепляются -связи С–С и С–Н. При этом образуются различные свободные радикалы. В результате взаимодействия радикалов с молекулами алканов и друг с другом образуется смесь низкомолекулярных алканов, алкенов и водорода.

2. Дегидрирование алканов .

3. Дегидратация спиртов .
СН 3 –СН 2 –ОН
 СН 2 =СН 2
+ Н 2 О
СН 2 =СН 2
+ Н 2 О
Механизм реакции:
СН 3 –СН 2 –ОН + НО–SO 3 H CH 3 –CH 2 –O–SO 3 H + H 2 O
этанол серная кислота этилсерная кислота
CH 3 –CH 2 –O–SO 3 H
 СН 2 =СН 2
+ НО–SO 3 H
СН 2 =СН 2
+ НО–SO 3 H
При дегидратации спиртов водород предпочтительнее отщепляется по правилу А.М. Зайцева (1875 г.) – от того из соседних атомов углерода, который беднее водородом (наименее гидрогенизирован):
4. Дегидрогалогенирование галогенопроизводных .
Этот процесс также протекает по правилу А.М. Зайцева:
5. Дегалогенирование дигалогенопроизводных .
Физические свойства
По физическим свойствам алкены мало отличаются от алканов с тем же числом атомов углерода в молекуле. Низшие гомологи С 2 –С 4 при н.у. – газы; С 5 –С 17 – жидкости; высшие гомологи – твердые вещества. Алкены не растворимы в воде. Хорошо растворимы в органических растворителях.
Химические свойства
Характерная особенность р-электронов – их подвижность, они менее прочно удерживаются ядрами атомов, чем -электроны. Поэтому -связь под действием электрофильных реагентов легко поляризуется и гетеролитически рвется, в связи с чем для алкенов характерны реакции присоединения.
Кроме этого, алкены легко вступают в реакции окисления и полимеризации по двойной связи.
1. Реакции электрофильного присоединения .
– Гидрогалогенирование (присоединение галогеноводорода).
СН 3 –СН=СН–СН 3 + НСl СН 3 –СН 2 –СНСl–СН 3
Если в реакции участвует несимметричный алкен (например, пропен), то преимущественное направление реакции определяется правилом В.В. Марковникова (1869 г.): при присоединении молекул типа НХ (где Х – атом галогена, группа ОН и др.) к несимметричным алкенам атом Н присоединяется к более гидрированному атому С молекулы алкена:
СН 3 –СН=СН 2 + НВr СН 3 –СНВr–СН 3 .
пропен 2-бромпропан
Это можно объяснить исходя из следующих соображений:
1). Распределение электронной плотности в нереагирующей молекуле (статический фактор ) – метильный радикал отталкивает от себя электронную плотность связи С–С. Вследствие этого происходит поляризация -связи:

Полярная молекула НВr ориентируется атомом Н к молекуле пропена за счет электростатического притяжения к электронам двойной связи; происходит ионный разрыв связи Н–Вr, и ион Н + притягивается преимущественно к первому атому С молекулы пропена и присоединяется к нему за счет электронной пары -связи. На среднем атоме С молекулы пропена возникает заряд «+» (молекула превращается в карбкатион):
Затем бромид-ион присоединяется к положительно заряженному атому С карбкатиона:

2). Устойчивость
образующегося карбкатиона (динамический
фактор
).
Взаимодействие иона Н +
с молекулой пропена теоретически может
привести и к образованию карбкатиона
 (ион пропения-1). Однако это не происходит,
т.к. в силу того, что алкильные радикалы
(СН 3 ,
СН 3 –СН 2 )
отталкивают электронную плотность от
себя и гасят положительный заряд атома
углерода, ион пропения-2
(ион пропения-1). Однако это не происходит,
т.к. в силу того, что алкильные радикалы
(СН 3 ,
СН 3 –СН 2 )
отталкивают электронную плотность от
себя и гасят положительный заряд атома
углерода, ион пропения-2  оказывается устойчивее, чем ион
пропения-1. Это также говорит в пользу
направления реакции по правилу
Марковникова.
оказывается устойчивее, чем ион
пропения-1. Это также говорит в пользу
направления реакции по правилу
Марковникова.
– Гидратация.
Этот процесс также протекает по правилу В.В. Марковникова:

– Галогенирование (качественная реакция на двойную связь ).

Наблюдается обесцвечивание бромной воды.
2. Реакции окисления и восстановления .
– Реакция Е.Е. Вагнера (1888 г.) – качественная реакция на двойную связь.
3СН 2 =СН 2 + 2KMnO 4 + 4H 2 O 3HO–CH 2 –CH 2 –OH + 2KOH + 2MnO 2
этиленгликоль
Наблюдается выделение бурого осадка оксида марганца (IV) и обесцвечивание раствора перманганата калия.
В кислой среде реакция алкенов с перманганатом калия идет с разрывом связи С=С, поэтому образуются соответствующие карбоновые кислоты или кетоны:
5Н 3 C–CH=CH–CH 3 + 8KMnO 4 + 12H 2 SO 4 10H 3 C–COOH + 8MnSO 4 + 4K 2 SO 4 + 12H 2 O
бутен -2 уксусная кислота
5Н 3 C–CH=C(СH 3)–CH 3 + 6KMnO 4 + 9H 2 SO 4
2-метилбутен-2
5H 3 C–COOH + 5H 3 C–CO–CH 3 + 6MnSO 4 + 3K 2 SO 4 + 9H 2 O
уксусная кислота пропанон (ацетон)
– Гидрирование.
Н 3 C–CH=CH–CH 3
+ Н 2
 Н 3 C–CH 2 –CH 2 –CH 3
Н 3 C–CH 2 –CH 2 –CH 3
В качестве катализаторов в этой реакции, кроме никеля, могут использоваться платина и палладий.
3. Реакции полимеризации .
Реакция полимеризации – это последовательное присоединение молекул ненасыщенных соединений друг к другу с образованием высокомолекулярного соединения – полимера.
Наиболее распространенными полимерами углеводородной природы являются полиэтилен и полипропилен.
nН 2 С=СН 2 (–СН 2 –СН 2 –) n
этилен полиэтилен
Алканами в химии называют предельные углеводороды, у которых углеродная цепь является незамкнутой и состоит из углерода, связанных друг с другом при помощи одинарных связей. Также характерной особенностью алканов есть то, что они совсем не содержат двойных либо тройных связей. Порой алканы называют парафинами, дело в том, что парафины собственно и являются смесью предельных углеродов, то есть алканов.
Формула алканов
Формулу алкана можно записать как:
При этом n больше или равно 1.
Алканам свойственна изомерия углеродного скелета. При этом соединения могут принимать разные геометрические формы, как например это показано на картинке ниже.

Изомерия углеродного скелета алканов
С увеличением роста углеродной цепи увеличивается и количество изомеров. Так, например, у бутана есть два изомера.

Получение алканов
Алкан как правило получают различными синтетическими методами. Скажем, один из способов получения алкана предполагает реакцию «гидрирования», когда алканы добываются из ненасыщенных углеводов под воздействием катализатора и при температуре.
Физические свойства алканов
Алканы от других веществ отличаются полным отсутствием цвета, также они не растворим в воде. Температура плавления алканов повышается с увеличением их молекулярной массы и длины углеводородной цепи. То есть чем более разветвленным является алкан, тем у него большая температура горения и плавления. Газообразные алканы и вовсе горят бледно-голубым или бесцветным пламенем, при этом выделяя много тепла.
Химические свойства алканов
Алканы в химическом плане малоактивные вещества, по причине прочности крепких сигма связей С-С и С-Н. При этом связи С-С неполярны, а С-Н малополярны. А так как все это малополяризируемые виды связей, которые относятся к сигма виду, то разрываться они будут по механизму гомолитическому, в результате чего образуются радикалы. И как следствия химические свойства алканов представляют собой в основном реакции радикального замещения.
Так выглядит формула радикального замещения алканов (галогенирование алканов).
Помимо этого также можно выделить такие химические реакции как нитрирование алканов (реакция Коновалова).
Реакция эта протекает при температуре 140 С, причем лучше всего именно с третичным атомом углерода.
Крекинг алканов – эта реакция протекает при действии высоких температур и катализаторов. Тогда создаются условия, когда высшие алканы могут рвать свои связи образуя алканы более низкого порядка.
Алканы являются насыщенными углеводородами и содержат максимально возможное число атомов водорода. Простейшим представителем класса является метан (CH 4).
По номенклатуре ИЮПАК названия алкано в образуются при помощи суффикса -ан путём добавления к соответствующему корню от названия углеводорода. Выбирается наиболее длинная неразветвлённая углеводородная цепь так, чтобы у наибольшего числа заместителей был минимальный номер в цепи. В названии соединения цифрой указывают номер углеродного атома, при котором находится замещающая группа или гетероатом, затем название группы или гетероатома и название главной цепи.
Для алканов характерен тип гибридизации - sp 3 .
Пространственное строение - у метана тетраэдрическая форма молекулы, у алканов n>4 - зигзагообразная форма.
Изомерия предельных углеводородов обусловлена простейшим видом структурной изомерии - изомерией углеродного скелета. Гомологическая разница - -CH 2 -.
Физические свойства
Температуры плавления и кипения увеличиваются с молекулярной массой и длиной главной углеродной цепи. При нормальных условиях неразветвлённые алканы с CH 4 до C 4 H 10 - газы; с C 5 H 12 до C 13 H 28 - жидкости; после C 14 H 30 - твёрдые тела. Температуры плавления и кипения понижаются от менее разветвленных к более разветвленным. Газообразные алканы горят бесцветным или бледно-голубым пламенем с выделением большого количества тепла.
Химические свойства алканов
1. Реакции замещения.
Галогенирование - это одна из реакций замещения. В первую очередь галогенируется наименее гидрированый атом углерода (третичный атом, затем вторичный, первичные атомы галогенируются в последнюю очередь). Галогенирование алканов проходит поэтапно - за один этап замещается не более одного атома водорода:
CH 4 + Cl 2 → CH 3 Cl + HCl (хлорметан)
CH 3 Cl + Cl 2 → CH 2 Cl 2 + HCl (дихлорметан)
CH 2 Cl 2 + Cl 2 → CHCl 3 + HCl (трихлорметан)
CHCl 3 + Cl 2 → CCl 4 + HCl (тетрахлорметан).
Нитрование алканов (реакция Коновалова)
На алканы действует pазбавленная азотная кислота пpи нагpевании и давлении. В pезультате пpоисходит замещение атома водоpода на остаток азотной кислоты – нитpогpуппу NO 2 .
R- H + HO -NO 2 → R-NO 2 + H 2 O
Эту pеакцию называют pеакцией нитpования, а пpодукты pеакции – нитpосоединениями.
2. Горение.
Основным химическим свойством предельных углеводородов, определяющих их использование в качестве топлива, является реакция горения. Пример:
CH 4 + 2O 2 → CO 2 + 2H 2 O + Q
Значение Q достигает 46 000 - 50 000 кДж/кг.
В случае нехватки кислорода вместо углекислого газа получается угарный газ или уголь (в зависимости от концентрации кислорода).
В общем виде реакцию горения алканов можно записать следующим образом:
С n Н 2n+2 + (1,5n+0,5)O 2 → nCO 2 + (n+1)H 2 O
3. Крекинг алканов.
Реакции разложения происходят лишь под влиянием больших температур. Повышение температуры приводит к разрыву углеродной связи и образованию свободных радикалов.
CH 4 → C + 2H 2 (t > 1000 °C)
C 2 H 6 → 2C + 3H 2
Крекинг – процесс термического разложения углеводородов, в основе которого лежат реакции расщепления углеродной цепи крупных молекул с образованием соединений с более короткой цепью.
Термический крекинг. При температуре 450–700 o С алканы распадаются за счет разрыва связей С–С (более прочные связи С-Н при такой температуре сохраняются) и образуются алканы и алкены с меньшим числом углеродных атомов.
Например:
C 6 H 14 → C 2 H 6 + C 4 H 8
Каталитический крекинг проводят в присутствии катализаторов (обычно оксидов алюминия и кремния) при температуре450°С и атмосферном давлении. При этом наряду с разрывом молекул происходят реакции изомеризации и дегидрирования:
2CH 4 1500 ° C → H–C≡C–H (ацетилен) + 3H 2
4. Изомеризация.
Под влиянием катализаторов при нагревании углеводороды нормального строения подвергаются изомеризации - перестройке углеродного скелета с образованием алканов разветвленного строения.
CH 3 –CH 2 –CH 2 –CH 2 –CH 3 (пентан) –t°,AlCl 3 → CH 3 –CH 2 –CH 2 –CH 3 I
CH 3 (2-метилбутан)
5. Дегидрирование алканов
При нагревании алканов в присутствии катализаторов происходит их каталитическое дегидрирование за счет разрыва связей С-Н и отщепления атомов водорода от соседних углеродных атомов. При этом алкан превращается в алкен с тем же числом углеродных атомов в молекуле:
C n H 2n+2 → C n H 2n + H 2
CH 3 -CH 3 → CH 2 =CH 2 + H 2 (этан → этен)
CH 3 -CH 2 -CH 2 -CH 3 → CH 2 = CH-CH 2 -CH 3 + H 2 (бутан → бутен-1 )
Наряду с бутеном-1 в этой реакции образуется также бутен-2.
6. Реакции окисления алканов
Алканы - соединения с низкими степенями окисления углерода, и в зависимости от условий реакции они могут окисляться с образованием различных соединений.
Получение алканов
Алканы выделяют из природных источников (природный и попутный газы, нефть, каменныйуголь). Используются также синтетические методы.
1. Крекинг нефти (промышленный способ)
При крекинге алканы получаются вместе с непредельными соединениями (алкенами). Этот способ важен тем, что при разрыве молекул высших алканов получается очень ценное сырье для органического синтеза: пропан, бутан, изобутан, изопентан идр.
2. Гидpиpование непpедельных углеводоpодов:
C n H 2n + H2 →C n H 2n+2 ← -H2 C n H 2n-2
алкены → алканы ← алкины
3. Газификация твердого топлива (при повышенной температуре и давлении, катализатор Ni):
С + 2Н 2 → СН 4
4. Из синтез-газа (СО + Н 2) получают смесь алканов:
nСО + (2n+1)Н 2 → C n H 2n+ 2 + nH 2 O
5. Синтез более сложных алканов из галогенопpоизводных с меньшим числом атомов углеpода:
2CH 3 Cl + 2Na → CH 3 -CH 3 + 2NaCl (реакция Вюрца)
6. Из солей карбоновых кислот:
а) сплавление со щелочью (реакция Дюма
CH 3 COONa + NaOH → CH 4 + Na 2 CO 3
ацетат натрия
б) электролиз по Кольбе
2RCOONa + 2H 2 O → R-R + 2CO 2 + H 2 + 2NaOH
на аноде → на катоде
7. Разложение карбидов металлов (метанидов) водой:
Al 4 C 3 + 12HOH → 4Al(OH) 3 + 3CH 4
Применение алканов.
Предельные углеводороды находят широкое применение в самых разнообразных сферах жизни и деятельности человека.
Газообразные алканы (метан и пpопан-бутановая смесь) используются в качестве ценного топлива.
Жидкие углеводоpоды составляют значительную долю в моторных и ракетных топливах и используются в качестве растворителей.
Вазелиновое масло (смесь жидких углеводоpодов с числом атомов углерода до 15) - пpозpачная жидкость без запаха и вкуса, используется в медицине, паpфюмеpии и косметике.
Вазелин (смесь жидких и твеpдых пpедельных углеводоpодов с числом углеpодных атомов до 25) пpименяется для пpиготовления мазей, используемых в медицине.
Паpафин (смесь твеpдых алканов С 19 - С 35) - белая твеpдая масса без запаха и вкуса (t пл = 50-70°C) - пpименяется для изготовления свечей, пpопитки спичек и упаковочной бумаги, для тепловых пpоцедуp в медицине и т.д.
Нормальные предельные углеводороды средней молекулярной массы используются как питательный субстрат в микробиологическом синтезе белка из нефти.
Большое значение имеют галогенопроизводные алканов, которые используются как растворители, хладоагенты и сырье для дальнейших синтезов.
В современной нефтехимической промышленности предельные улеводороды являются базой для получения разнообразных органических соединений, важным сырьем в процессах получения полупродуктов для производства пластмасс, каучуков, синтетических волокон, моющих средств и многих других веществ.
Алканы с химической точки зрения представляют собой углеводороды, то есть общая формула алканов включает в себя исключительно атомы углерода и водорода. Помимо того, что эти соединения не содержат никаких функциональных групп, они образуются только за счет одинарных связей. Такие углеводороды называются насыщенными.
Типы алканов
Все алканы можно выделить в две большие группы:
- Алифатические соединения. Их структура имеет вид линейной цепочки, общая формула алканов алифатического типа C n H 2n+2 , где n - количество атомов углерода в цепи.
- Циклоалканы. Эти соединения имеют циклическую структуру, что обуславливает существенное отличие их химических свойств от линейных соединений. В частности, структурная формула алканов этого типа обуславливает сходство их свойств с алкинами, то есть углеводородами с тройной связью между атомами углерода.
Электронная структура алифатических соединений
Эта группа алканов может иметь либо линейную, либо разветвленную углеводородную цепь. Их химическая активность является невысокой по сравнению с другими органическими соединениями, поскольку все связи внутри молекулы являются насыщенными.
Молекулярная формула алканов алифатического типа говорит о том, что их химическая связь имеет sp 3- гибридизацию. Это означает, что все четыре ковалентные связи вокруг атома углерода по своим характеристикам (геометрическим и энергетическим) являются абсолютно равноправными. При таком типе гибридизации электронные оболочки уровней s и p атомов углерода имеют одинаковую форму вытянутой гантели.
Между атомами углерода связь в цепи является ковалентной, а между атомом углерода и водорода она частично поляризована, при этом электронная плотность оттягивается к углероду, как к элементу более электроотрицательному.
Из следует, что в их молекулах существуют только связи C-C и C-H. Первые образуются в результате перекрывания двух электронных гибридизованных орбиталей sp 3 двух атомов углерода, а вторые образуются при перекрывании орбитали s водорода и орбитали sp 3 углерода. Длина связи C-C равна 1,54 ангстрема, а связи C-H - 1,09 ангстрема.
Геометрия молекулы метана
Метан является самым простым алканом, который состоит всего из одного атома углерода и четырех атомов водорода.
Благодаря энергетической равноправности его трех 2p и одной 2s орбиталей, полученной в результате sp 3 -гибридизации, все орбитали в пространстве расположены под одинаковым углом друг к другу. Он равен 109,47°. В результате такой молекулярной структуры в пространстве образуется подобие треугольной равносторонней пирамиды.

Простые алканы
Самым простым алканом является метан, который состоит из одного атома углерода и четырех атомов водорода. Следующие в ряду алканов за метаном пропан, этан и бутан образованы тремя, двумя и четырьмя атомами углерода соответственно. Начиная с пяти атомов углерода в цепи, соединения получили название согласно номенклатуре ИЮПАК.
Таблица с формулами алканов и их названиями приведена ниже:
При потере одного водородного атома у молекулы алкана образуется активный радикал, окончание которого меняется с "ан" на "ил", например, этан C 2 H 6 - этил C 2 H 5 . Структурная формула алкана этана приведена на фото.

Номенклатура органических соединений
Правила определения названий алканов и соединений на их основе установлены международной номенклатурой ИЮПАК. Для органических соединений действуют следующие правила:
- Название химического соединения базируется на названии его самой длинной цепи из атомов углерода.
- Нумерацию атомов углерода следует начинать с конца, ближе к которому начинается разветвление цепи.
- Если в соединении присутствуют две или более углеродные цепи одинаковой длины, то в качестве основной выбирается та, которая имеет меньше всего радикалов, и они имеют более простую структуру.
- Если в молекуле имеются две и более одинаковые группы радикалов, тогда в названии соединения используются соответствующие префиксы, которые удваивают, утраивают и так далее названия указанных радикалов. Например, вместо выражения "3-метил-5-метил" используется "3,5-диметил".
- Все радикалы записываются в алфавитном порядке в общее название соединения, при этом префиксы не берутся во внимание. Последний радикал пишется слитно с названием самой цепи.
- Числа, отражающие номера радикалов в цепи, отделяются от названий дефисом, а сами цифры записываются через запятую.
Соблюдение правил номенклатуры ИЮПАК позволяет легко определить молекулярную формулу алкана по например, 2,3-диметилбутан имеет следующий вид.

Физические свойства
Физические свойства алканов во многом зависят от длины углеродной цепи, образующей конкретное соединение. Основными свойствами являются следующие:
- Первые четыре представителя, согласно общей формуле алканов, при нормальных условиях находятся в газообразном состоянии, то есть это бутан, метан, пропан и этан. Что касается пентана и гексана, то они существуют уже в виде жидкостей, а начиная с семи атомов углерода, алканы представляют собой твердые вещества.
- При увеличении длины углеродной цепи увеличивается и плотность соединения, а также его температуры фазовых переходов первого рода, то есть температуры плавления и кипения.
- Поскольку полярность химической связи в формуле вещества алканов является незначительной, они не растворяются в полярных жидкостях, например, в воде.
- Соответственно их можно использовать в качестве хороших растворителей таких соединений, как неполярные жиры, масла и воски.
- В домашней газовой плите используется смесь алканов, богатая третьим членом химического ряда - пропаном.
- При кислородном горении алканов выделяется большое количество энергии в виде тепла, поэтому эти соединения используют в качестве горючего топлива.
Химические свойства
Ввиду наличия стабильных связей в молекулах алканов, их реакционная способность в сравнении с другими органическими соединениями является низкой.
С ионными и полярными химическими соединениями алканы практически не реагируют. Они ведут себя инертно в растворах кислот и оснований. Алканы вступают в реакцию только с кислородом и галогенами: в первом случае речь идет о процессах окисления, во втором - о процессах замещения. Некоторую химическую активность они проявляют и в реакциях с переходными металлами.
Во всех этих химических реакциях важную роль играют разветвления углеродной цепи алканов, то есть наличие в них радикальных групп. Чем их больше, тем сильнее изменяется идеальный угол между связями 109,47° в пространственной структуре молекулы, что приводит к созданию напряжений внутри нее и, как следствие, увеличивает химическую активность такого соединения.
Реакция простых алканов с кислородом происходит по следующей схеме: C n H 2n+2 + (1,5n+0,5)O 2 → (n+1)H 2 O + nCO 2 .
Пример реакции с хлором приведен на фото ниже.

Опасность алканов для природы и человека

Гептан, пентан и гексан представляют собой легко воспламеняющиеся жидкости и являются опасными как для окружающей среды, так и для здоровья человека, поскольку они токсичны.
Определение 1
Алканами называют такие углеводороды, атомы углерода, в молекулах которых соединены между собой простыми (одинарными) $\sigma $- связями. Все остальные единицы валентности атомов углерода в этих соединениях заняты (насыщенны) атомами водорода.
Атомы углерода в молекулах насыщенных углеводородов находятся в первом валентном состоянии, то есть в состоянии $sp3$-гибридизации. Такие насыщенные углеводороды еще называют парафинами .
Парафинами эти органические соединения называют потому, что долгое время их считали малореакцийноспособными (от лат. parum - мало и affinis - имеет сродство).
Старое название насыщенных углеводородов - алифатические или жирные, углеводороды (от лат. alifatic - жирный). Это название происходит от названия первых изученных соединений, которые когда-то относили к этим веществам, - жиров.
Насыщенные углеводороды образуют ряд соединений с общей формулой $C_nH_{(2_n+2)}$ $(n - 1, 2, 3, 4, ...)$. Простой соединением этого ряда является метан $CH_4$. Поэтому ряд этих соединений называют еще рядом метановых углеводородов.
Гомологические ряды
Соединения ряда метана имеют подобные строение и свойства. Такой ряд соединений, представители которого имеют близкие химические свойства и характеризуются закономерной сменой физических свойств, имеют однотипную структуру и отличаются друг от друга на одну или несколько $-CH_2$-групп, называют гомологичным рядом (от греч. «гомос » - сходство). Каждый последующий углеводород данного ряда отличается от предыдущего на группу $-CH_2$. Эта группа называется гомологичной разницей, а отдельные члены этого ряда - гомологами.
Происхождение названий алканов
Названия первых четырех насыщенных углеводородов (метан, этан, пропан, бутан) возникли случайно. Например, корень слова «этан» произошел от латинского слова ether - эфиы, так как остаток этана $-C_2H_5$ входит в состав медицинского эфира. Начиная с $C_5H_{12}$, названия алканов образованы от греческих или латинских числительных, которые указывают количество углеродных атомов в молекуле данного насыщенного углеводорода с добавлением к этим названиям суффикса -ан. Так, углеводород $C_5H_{12}$ называется пентан (от греч. «пента » - пять), $C_6H_{14}$ - гексан (от греч. «гекса » - шесть), $C_7H_{10}$ - гептан (от греч. «гепта » - семь) и т. д.
Правила систематической номенклатуры
Для названия органических веществ комиссией Международного союза теоретической и прикладной химии (IUPAC) были разработаны правила систематической (научной) номенклатуры. Согласно этим правилам, названия углеводородам дают таким образом:
В молекуле углеводорода выбирают основную - длинную и сложную (которая имеет наибольшее число ответвлений) - углеродную цепь.
Нумеруют атомы углерода основной цепи. Нумерацию осуществляют последовательно с того конца цепи, который дает радикалу наименьший номер. Если существует несколько алкильных радикалов, то сравнивают величину цифр двух возможных последовательных нумерации. И нумерация, в которой первой встречается меньше цифра, чем во второй последовательной нумерации, считается «меньше» и используется для составления названия углеводорода.
Нумерация справа налево будет «меньше», чем нумерация слева направо.
Называют углеводородные радикалы, которые образуют боковые цепи. Перед названием каждого радикала ставят цифру, которая указывает номер углеродного атома главной цепи, у которого с находится данный радикал. Цифру от названия отделяют дефисом. Названия алкильных радикалов перечисляют в алфавитном порядке. Если углеводород имеет в своем составе несколько одинаковых радикалов, то записывают в порядке возрастания номера углеродных атомов, у которых стоят эти радикалы. Цифры отделяют друг от друга запятыми. После цифр записывают префиксы: ди- (если одинаковых радикалов два), три- (когда одинаковых радикалов три), тетра-, пента- и т. д. (если одинаковых радикалов соответственно четыре, пять и т. д.). Префиксы указывают, сколько одинаковых радикалов имеет данный углеводород. После префикса ставят название радикала. В том случае, если два одинаковых радикалы находятся у одного углеродного атома, номер этого атома углерода ставится в названии дважды.
Называют углеводород основной пронумерованной углеродной цепи, помня при этом, что названия всех насыщенных углеводородов имеют суффикс -ан.
Приведенный ниже пример поможет уяснить эти правила:
Рисунок 1.
Алкильные радикалы боковых цепей
Иногда алкильные радикалы боковых цепей разветвленные. В этом случае их называют так, как соответствующие насыщенные углеводороды, только вместо суффикса -ан принимают суффикс -ил.
Углеродную цепь разветвленного радикала нумеруют. Атом углерода этого радикала, соединенный с основным цепью, получает номер $1$. Для удобства углеродную цепь разветвленного радикала нумеруют цифрами со штрихами и полное название такого радикала берут в скобки:
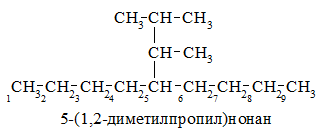
Рисунок 2.
Рациональная номенклатура
Кроме систематической для названия насыщенных углеводородов используют еще рациональную номенклатуру. По этой номенклатуре насыщенные углеводороды рассматривают как производные метана, в молекуле которого один или несколько атомов водорода замещены на радикалы. Название насыщенного углеводорода по рациональной номенклатуре образуют таким образом: называют по степени сложности все радикалы, которые находятся у атома углерода с наибольшим количеством заместителей (отмечая их количество, если они одинаковые), а затем добавляют основу названия углеводорода по этой номенклатуре - слово «метан». К примеру:

Рисунок 3.
Рациональную номенклатуру пользуются для названия сравнительно простых углеводородов. Эта номенклатура не так усовершенствована и гораздо менее удобна в пользовании по сравнению с систематической номенклатурой. По рациональной номенклатуре одно и то же вещество может иметь разные названия, что очень неудобно. Кроме того, по данной номенклатуре можно назвать далеко не все насыщенные углеводороды.